【临床研究】真实世界研究的关注点有哪些?请看!
来源:临床医学研究中心 发布时间:2022年4月26日
01、定义
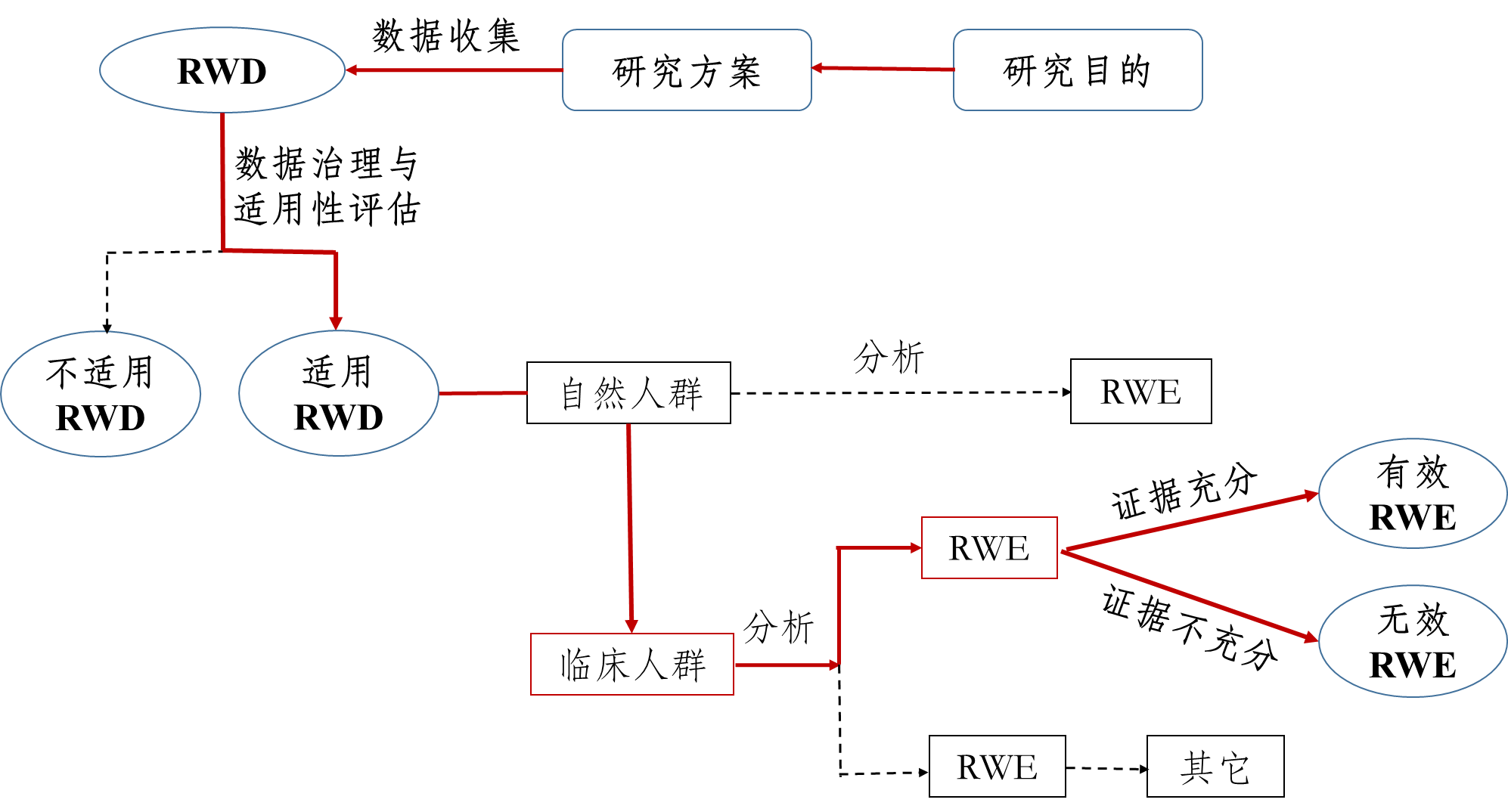
真实世界研究是指针对预设的临床问题,在真实世界环境下收集与研究对象健康有关的数据(真实世界数据)或基于这些数据衍生的汇总数据,通过分析,获得药物的使用情况及潜在获益-风险的临床证据(真实世界证据)的研究过程(如下图所示)。
▲支持药物监管决策的真实世界研究路径(实线所示)
图源自《真实世界证据支持药物研发与审评的指导原则(试行)》
02、近年来真实世界研究的政策及法规支持
1、《真实世界证据支持药物研发与审评的指导原则(试行)》(国家药监局通告2020年第1号)
2、《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》(国家药监局通告2020年第22号)
3、《真实世界数据用于医疗器械临床评价技术指导原则(试行)》(国家药品监督管理局通告2020年第77号)
4、《用于产生真实世界证据的真实世界数据指导原则(试行)》( 国家药品监督管理局药品审评中心通告2025-2026 年第27号)
03、真实世界研究与传统临床试验最核心区别
传统临床试验:是在严格控制的环境和条件下进行的。
真实世界研究:在真实环境和条件下进行的,特点是受试者不加限制条件,干预方法就是医生与患者沟通,都是真实情形下进行。
主要区别点:在病例的纳入和排除标准(纳排标准)上两者区别明细,其次真实世界研究的样本量一般较大。
04、真实世界研究的分类及主要应用场景
分类:大致分为非干预性(观察性)研究和干预性研究。非干预性(观察性)研究又可以细分为包括不施予任何干预措施的回顾性和前瞻性观察性研究,患者的诊疗、疾病的管理、信息的收集等完全依赖于日常医疗实践;而干预性研究与非干预性(观察性)研究最大的不同是主动施予某些干预措施,如实用临床试验等。
应用场景:
1.为新药注册上市提供有效性和安全性的证据
2.为已上市药物的说明书变更提供证据
3.为药物上市后要求或再评价提供证据
05、展望
近年来有关真实世界研究的政策及法规的在不断更新,监管体系亦不断完善,很大程度上推进了申办者有效规范真实世界证据,提高了真实世界研究的可靠性。希接下来在政策的扶持下,申办者们可进一步创新研究模式,一同解决真实世界研究项目落地的实际问题与困难,推进我国真实世界研究在药物研发与监管决策中的实践进程。
广东省临床医学学会-临床医学研究中心针对临床研究项目已开设了方案设计辅导、项目经费管理、数据系统配置与统计分析服务、申办方项目承接及管理、科研经费资助等一体化服务内容,如需了解详情,可拨打文末联系电话。