【临床研究】真实世界研究的未来新视角!
来源:临床医学研究中心 发布时间:2022年12月9日
近年来,如何通过真实世界证据来评价临床使用药物的有效性和安全性,已成为国内外日益关注的热点话题。真实世界研究(Real World Study,RWS)起源于药物上市后评价的实用性临床研究,RWS的研究、设计和实施从临床实际出发,均以患者为中心,其评价的结局也以患者关心的结局为主,并最终以改善患者的健康状况、疾病、功能为主要目标。
国家对真实世界研究的政策支持力度近年来也在日益增大,国家药品监督管理局相继发布了《真实世界证据支持药物研发与审评的指导原则(试行) 》、《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》、《真实世界证据支持药物注册申请的沟通交流指导原则(征求意见稿)》、《用于产生真实世界证据的真实世界数据指导原则(试行)》等内容,为国内真实世界研究的开展提供了有力的政策支持,本文就真实世界研究在药物研发中的应用和如何开展研究等内容进行小结分享。
一、真实世界研究如何助力药物研发与审评
(一)为新药注册上市提供有效性和安全性的证据
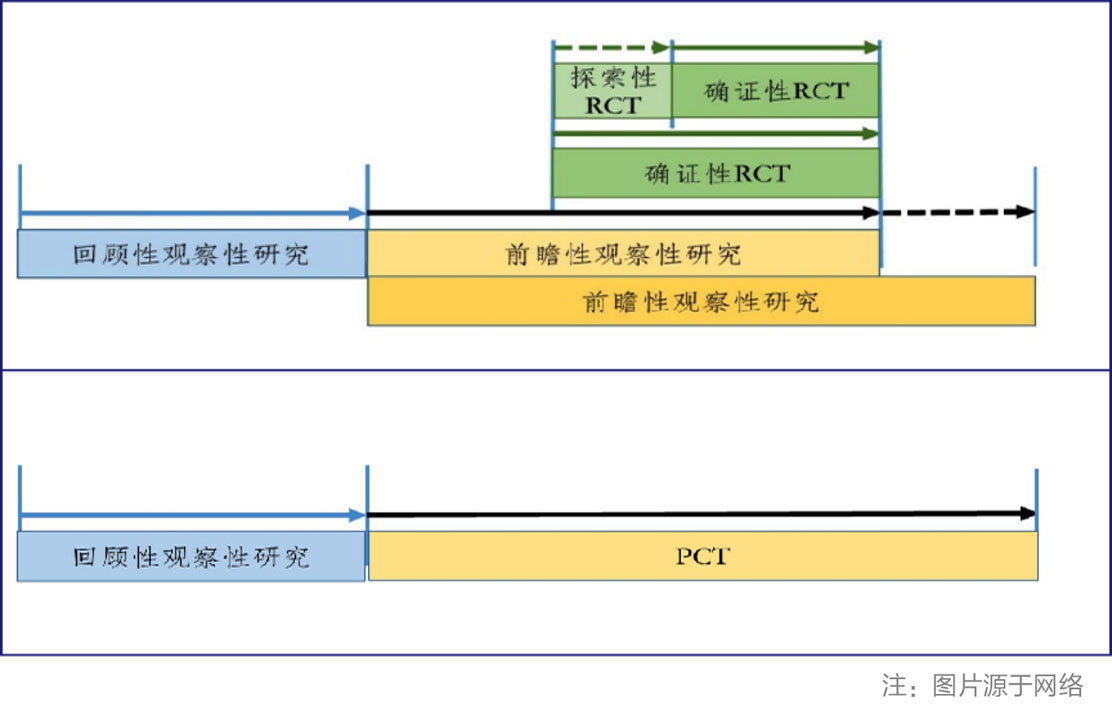
使用真实世界数据获得的结局或安全性数据的RCT(随机对照试验),包括PCT(实效性随机对照临试验)设计等,获得新药注册上市临床证据。
▲观察性研究与RCT及PCT研究相结合的路径
(二)为已上市药物的说明书变更提供证据
1)增加或者修改适应症;
2)改变剂量、给药方案或者用药途径;
3)增加新的适用人群;
4)添加实效比较研究的结果;
5)增加安全性信息;
6)说明书的其它修改。
(三)为药物上市后要求或再评价提供证据
(四)名老中医经验方、中药医疗机构制剂的人用经验总结与临床研发
(五)真实世界证据用于监管决策的其它应用
1)指导临床研究设计;
2)精准定位目标人群。
二、从临床角度如何开展真实世界研究
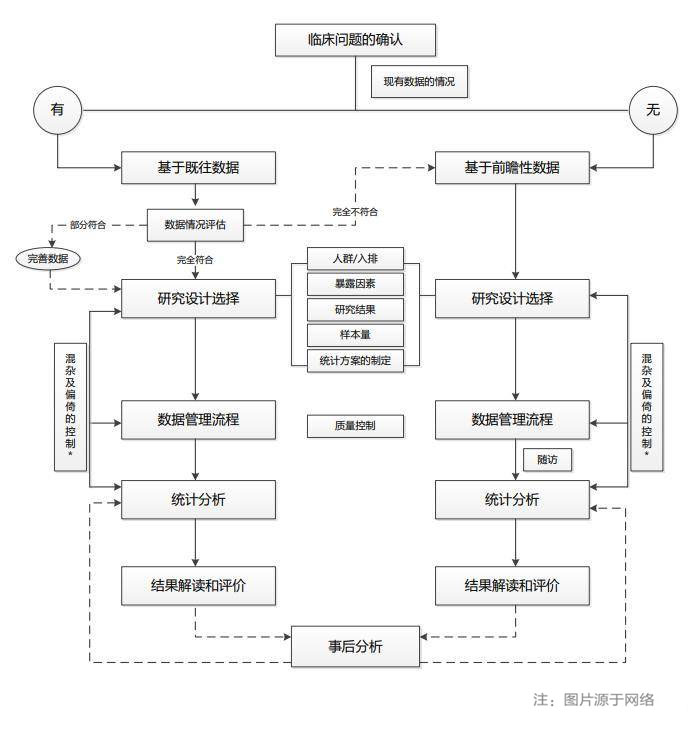
(一)真实世界研究设计需考虑的要素
首先,了解数据源基本特征是前提:内容、结构、标准化程度、可及性,准确掌握将“临床问题转化为科研问题”的精髓。
1.基于PICO选择数据源:
1)研究问题细化为PICO,形成研究假设;
2)选择有相关变量的数据源,评价所需数据的质量和可用性;
3)算法的真实性评价。
注:P是指Participants/Patients(研究对象),I是指Intervention(干预措施),在真实世界研究中可以理解为暴露因素。C是指Control/Comparison (对照或比较措施),O是指Outcome(研究结局)。
2.选择恰当的研究设计和分析方法
1)描述性VS分析性VS实验性;
2)回顾性VS前瞻性VS双向;
3)样本量估算,确定数据源时间范围;
4)偏倚和混杂的处理。
3.合理解释结果
1)代表性和准确性;
2)相关/关联/因果。
(二)如何获取高质量的临床数据
真实世界研究水平及严谨性依赖于高质量临床研究数据,在研究过程中,真实世界数据获取途径多样化、不同数据系统的数据管理机制和标准不同,在顶层设计时需考虑到数据质量并重的因素。
1.遵循数据质量基本要求
在采集数据的同时,需注重遵循可溯源性(attributable)、易读性(legible)、同时性(contemporaneous)、原始性(original)、准确性(accurate)、完整性(complete)、一致性(consistent)、 持久性(enduring)和可用性(available)标准,简称ALCOA+CCEA标准。
2.掌握采集数据要点
(1)基于后续数据可实行注册的考量;
(2)征得患者得知情同意;
(3)制定明确的数据处理过程即个人数据应用透明化;
(4)不可过度收集数据。
3.选择最优的数据治理方法
在临床研究数据库构建时需考虑消除信息孤岛、控制冗余、实现数据的可利用性,同时也是真实世界研究中医疗数据治理的关键问题,数据治理执行中需要将重点放在数据架构、数据模型、数据标准、数据质量、主数据、时效性管理、生命周期管理、元数据、数据安全和数据洞察等方面。
(三)采用恰当的统计分析方法
真实世界研究中的统计分析方法主要是因果推断方法,其中特别需要注意对混杂效应的控制或调整,以避免得出有偏倚的效应估计,以下仅对部分常用的因果推断方法做概括性说明。
1.描述性分析和非调整分析
真实世界研究通常需要从大量协变量中考虑可能的混杂因素,利用描述性统计分析对受试者的相关特征进行广泛和全面的探索性分析是非常必要的
2.调整分析
1)选择协变量:限制了对经验学习的依赖性,在减小混杂效应的同时也减小了过度调整的风险。需注意的是,协变量的选择过程必须是公开、透明的。
2)利用回归模型进行调整分析:利用各类回归模型对潜在混杂因素进行调整,从而估计药物暴露的效应。
3)倾向评分:倾向评分定义为在观察到的协变量条件下,观察对象接受某种处理(或暴露)的概率,可以综合概括所有已观测到的协变量的组间均衡性。
4)疾病风险评分(Disease Risk Score,DRS):对于结局事件常见但处理(暴露)因素罕见、或者可能存在多重暴露的研究,DRS方法是一种较好的选择,能够平衡不同组间样本的基线疾病风险。
5)工具变量:工具变量必须与暴露和结局的所有观测到或未观测到的混杂因素不相关。变量对结局不能有直接影响,除非通过处理至结局的通路间接作用于结局。变量必须与研究的处理因素相关,而且相关性越高越好。
3.缺失数据考虑
缺失数据在真实世界研究中通常难以避免,不仅结局变量可能缺失,协变量也有可能缺失。研究者和申办方应考虑优化试验设计,尽可能地将缺失率降到最低。
4.敏感性分析和偏倚的定量分析
敏感性分析可以检测未观测的协变量对疗效估计偏倚的影响,协助确定基于接受治疗概率而估计的疗效的上下限,关于偏倚的定量分析,应保证分析过程透明、可信。
结语
在以药品真实问题为导向的真实世界研究中,以不同问题为导向去设计、实施相关研究路线,应用多种研究方法去解决相关问题,可为药品注册、上市提供安全性和有效性证据,为上市后再评价提供补充材料,发现早期药物警戒信号,了解社会医药资源的配置和利用效率等,因此,在临床中开展真实世界研究的意义越来越重大。
目前,真实世界研究在持续升温,国内有海南乐城区在真实世界研究路上的探索经验,随着国家政策的支持和对临床研究市场的日益重视,相信国内RWS的体量会持续增加,未来真实世界研究的视角将更加宽广,可解决的临床问题和应用领域势必不断扩宽,期待真实世界研究更精彩的未来。
参考来源:
1.国家药品监督管理局药品审评中心.《药物真实世界研究设计与方案框架指导原则(征求意见稿)》(2022.7.7发布)
2.国家药品监督管理局. 《真实世界证据支持药物研发与审评的指导原则(试行)》. 2020.
3. 国家药品监督管理局. 《用于产生真实世界证据的真实世界数据指导原则(试行)》. 2025-2026 .
4.国家药品监督管理局. 《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》. 2020.
5.国家药品监督管理局. 《罕见疾病药物临床研发技术指导原则(试行)》.2022.
6.国家药品监督管理局. 《单臂试验支持上市的抗肿瘤药上市许可申请前临床方面沟通交流技术指导原则(试行)》. 2020.