

 【培训通知-已报名学员请重点关注】“研究者发起临床研究实施管理研讨培训班”限额200人,先到先得!
发布时间:2022年10月12日
【培训通知-已报名学员请重点关注】“研究者发起临床研究实施管理研讨培训班”限额200人,先到先得!
发布时间:2022年10月12日 【临床研究】重磅!重磅!CDE五连发
发布时间:2022年10月10日
【临床研究】重磅!重磅!CDE五连发
发布时间:2022年10月10日 【培训通知】关于召开“研究者发起临床研究实施管理研讨培训班暨成立临床医学研究中心-临床研究质量保证部”会议通知
发布时间:2022年9月28日
【培训通知】关于召开“研究者发起临床研究实施管理研讨培训班暨成立临床医学研究中心-临床研究质量保证部”会议通知
发布时间:2022年9月28日 【骨干招募】广东省临床医学学会-临床医学研究中心-临床研究质量保证部骨干纳新招募通知
发布时间:2022年9月27日
【骨干招募】广东省临床医学学会-临床医学研究中心-临床研究质量保证部骨干纳新招募通知
发布时间:2022年9月27日 【临床研究】临床试验成本之大,如何管控?
发布时间:2022年9月13日
【临床研究】临床试验成本之大,如何管控?
发布时间:2022年9月13日 【临床研究】关于公开征求《抗肿瘤抗体偶联药物临床研发技术指导原则》意见的通知
发布时间:2022年9月20日
【临床研究】关于公开征求《抗肿瘤抗体偶联药物临床研发技术指导原则》意见的通知
发布时间:2022年9月20日 【临床研究】浅析药物临床试验质量风险管理
发布时间:2022年9月13日
【临床研究】浅析药物临床试验质量风险管理
发布时间:2022年9月13日 【临床研究】医疗器械临床试验,你知多少?
发布时间:2022年9月7日
【临床研究】医疗器械临床试验,你知多少?
发布时间:2022年9月7日 【临床研究】NMPA最新发布《医疗器械产品注册项目立卷审查要求》
发布时间:2022年9月6日
【临床研究】NMPA最新发布《医疗器械产品注册项目立卷审查要求》
发布时间:2022年9月6日 【临床研究】注册核查是什么?应关注哪些重点?
发布时间:2022年8月30日
【临床研究】注册核查是什么?应关注哪些重点?
发布时间:2022年8月30日 【临床研究】多中心临床试验管理应考虑哪些因素?
发布时间:2022年8月17日
【临床研究】多中心临床试验管理应考虑哪些因素?
发布时间:2022年8月17日 【临床研究】CDE最新指导原则三连发!“以患者为中心”的临床试验设计、实施、获益的“新潮”来了!
发布时间:2022年8月16日
【临床研究】CDE最新指导原则三连发!“以患者为中心”的临床试验设计、实施、获益的“新潮”来了!
发布时间:2022年8月16日 【临床研究】广东省临床医学学会-临床医学研究中心学术委员会成立大会顺利召开
发布时间:2022年8月8日
【临床研究】广东省临床医学学会-临床医学研究中心学术委员会成立大会顺利召开
发布时间:2022年8月8日 【临床研究】去中心化临床试验的机遇与挑战
发布时间:2022年8月7日
【临床研究】去中心化临床试验的机遇与挑战
发布时间:2022年8月7日 【临床研究】临床试验机构搭建质量管理体系,需关注的要点有哪些?
发布时间:2022年7月26日
【临床研究】临床试验机构搭建质量管理体系,需关注的要点有哪些?
发布时间:2022年7月26日 【临床研究】CDE发布:关于公开征求《药物临床试验盲法指导原则》意见的通知
发布时间:2022年7月25日
【临床研究】CDE发布:关于公开征求《药物临床试验盲法指导原则》意见的通知
发布时间:2022年7月25日 【临床研究】浅析药物临床试验中AE/SAE/SUSAR的管理要点
发布时间:2022年7月20日
【临床研究】浅析药物临床试验中AE/SAE/SUSAR的管理要点
发布时间:2022年7月20日 【临床研究】重点来了!《药物非临床安全性评价研究机构和药物临床试验机构监督管理细则》最新发布!
发布时间:2022年7月19日
【临床研究】重点来了!《药物非临床安全性评价研究机构和药物临床试验机构监督管理细则》最新发布!
发布时间:2022年7月19日 【临床研究】CDE发布《药物真实世界研究设计与方案框架指导原则(征求意见稿)》
发布时间:2022年7月12日
【临床研究】CDE发布《药物真实世界研究设计与方案框架指导原则(征求意见稿)》
发布时间:2022年7月12日 【临床研究】《成人2型糖尿病药物临床研发技术指导原则》征求意见稿发布了!
发布时间:2022年6月29日
【临床研究】《成人2型糖尿病药物临床研发技术指导原则》征求意见稿发布了!
发布时间:2022年6月29日 【临床研究】重磅!重磅!CDE发布《药物临床试验期间方案变更技术指导原则(试行)》
发布时间:2022年6月28日
【临床研究】重磅!重磅!CDE发布《药物临床试验期间方案变更技术指导原则(试行)》
发布时间:2022年6月28日 【临床研究】浅析药物临床试验中受试者依从性管理
发布时间:2022年6月22日
【临床研究】浅析药物临床试验中受试者依从性管理
发布时间:2022年6月22日 【临床研究】CDE最新发布:关于公开征求《单臂临床试验用于支持抗肿瘤药上市申请的适用性技术指导原则》意见的通知
发布时间:2022年6月21日
【临床研究】CDE最新发布:关于公开征求《单臂临床试验用于支持抗肿瘤药上市申请的适用性技术指导原则》意见的通知
发布时间:2022年6月21日 【临床研究】麦海强教授:卡瑞利珠单抗联合阿帕替尼治疗既往复发或转移性鼻咽癌的疗效和安全性:II期临床试验
发布时间:2022年6月14日
【临床研究】麦海强教授:卡瑞利珠单抗联合阿帕替尼治疗既往复发或转移性鼻咽癌的疗效和安全性:II期临床试验
发布时间:2022年6月14日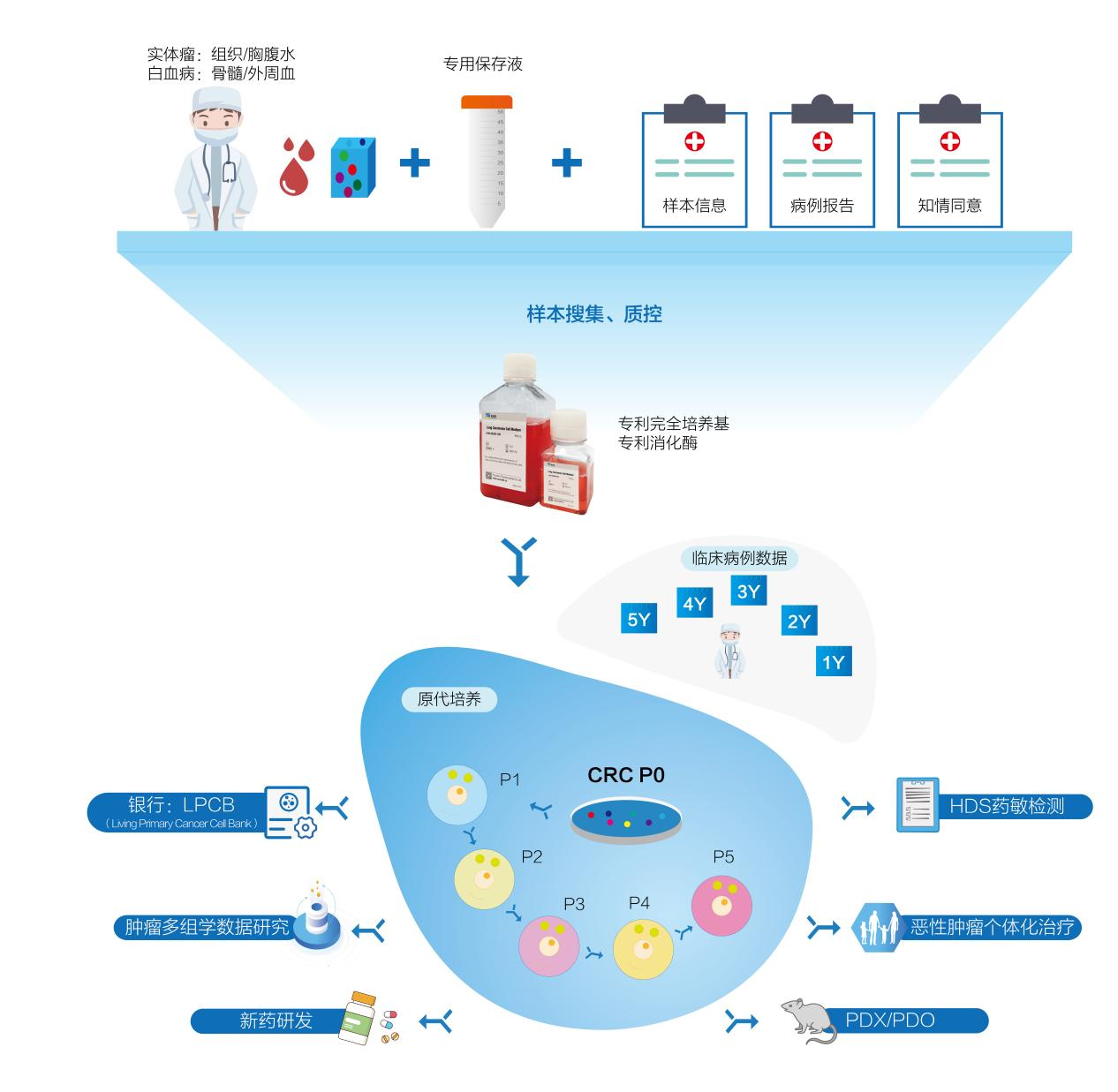 【临床研究】《肿瘤原代细胞药敏检测项目》 可再生肿瘤原代细胞及其药敏检测技术在临床诊疗中的应用
发布时间:2022年6月1日
【临床研究】《肿瘤原代细胞药敏检测项目》 可再生肿瘤原代细胞及其药敏检测技术在临床诊疗中的应用
发布时间:2022年6月1日 【临床研究】抗肿瘤药物说明书不良反应数据汇总指导原则
发布时间:2022年5月31日
【临床研究】抗肿瘤药物说明书不良反应数据汇总指导原则
发布时间:2022年5月31日 【临床研究】重磅!临床医学研究中心“万例癌症原代细胞”推出肿瘤原代细胞、类器官专利培养基1000份免费试用装!先到先得!
发布时间:2022年5月25日
【临床研究】重磅!临床医学研究中心“万例癌症原代细胞”推出肿瘤原代细胞、类器官专利培养基1000份免费试用装!先到先得!
发布时间:2022年5月25日 【临床研究】新形势下,药物临床试验方案设计应考虑的伦理审查因素
发布时间:2022年5月24日
【临床研究】新形势下,药物临床试验方案设计应考虑的伦理审查因素
发布时间:2022年5月24日 【临床研究】临床试验知情同意,需掌握的要点有哪些?
发布时间:2022年5月18日
【临床研究】临床试验知情同意,需掌握的要点有哪些?
发布时间:2022年5月18日 【临床研究】CDE又一指导原则更新啦! 《抗肿瘤治疗的免疫相关不良事件评价技术指导原则》正式发布!
发布时间:2022年5月17日
【临床研究】CDE又一指导原则更新啦! 《抗肿瘤治疗的免疫相关不良事件评价技术指导原则》正式发布!
发布时间:2022年5月17日| 上一页 | 3 | 下一页 |